TPPここが問題―薬の知財保護を強化
(全国保険医新聞2015年10月25日号より)
TPP交渉は10月5日、交渉参加12カ国による閣僚会合で「大筋合意」に達したが最終合意には至っていない。TPP交渉の協定文書は21分野31章で構成されている。医療分野に大きな影響を及ぼすのが、第8分野「知的財産」、第10分野「越境サービス(国境を越えるサービスの貿易)」、第12分野「金融サービス」、第15分野「投資」、第18分野「法的制度的事項」などである。TPP政府対策本部は5日、「環太平洋パートナーシップ協定(TPP協定)の概要」を公表した。現時点で明らかになった医療分野への影響について解説した。
TPP交渉では、医薬品が個別の交渉事項として取り上げられてきた。公表された「概要」では、「医薬品の知的財産保護を強化する制度の導入」が規定されたとして、①「特許期間延長制度」(特許期間の不合理な短縮について特許期間の調整を認める制度)、②「新薬のデータ保護期間に係るルールの構築」、③「特許リンケージ制度」(後発薬承認時に有効特許を確認する仕組み)の3つの制度が導入されると説明している。
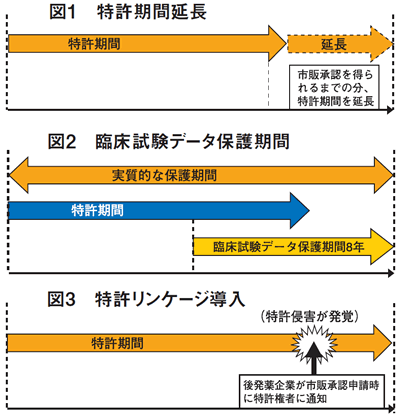

特許期間を延長
新薬の開発は、新薬の元になる有効物質の特許の出願を特許当局に行った後に、新薬の開発及び臨床試験を経て、医薬品規制当局(日本の場合は、厚労省「医薬・生活衛生局」)に市販承認申請を行う。当局の審査を経て市販承認されるまで、5年から15年の期間を要するとされている。
米国は、市販承認されるまでの年数分、特許期間が「浸食」されていると主張し、「浸食」されている年数分だけ特許期間を延長して、特許権者に補償するよう強く要求していた(図1)。
データ保護期間は8年
米国は、バイオ医薬品を開発した製薬企業の独占的販売を保障するため、臨床試験データ保護期間を12年とするようTPP交渉の最終段階まで主張していたが、8年とすることで「大筋合意」したと報じられている(図2)。
バイオ医薬品は遺伝子組み換えなどのバイオテクノロジーで開発する医薬品だ。主に抗がん剤やC型肝炎、糖尿病などの疾病の治療に使われている。経済産業省によると世界のバイオ医薬品市場は10年の900億ドル(10兆8000億円)から15年には1900億ドル(22兆8000億円)まで拡大すると見込まれている。
特許期間とは別にデータの保護期間を設けることで、今後、ジェネリック薬企業の参入に対する新たな障壁が出現することになる。国際医療支援団体の「国境なき医師団」は、「発展途上国の医薬品入手の面で最悪の貿易協定として歴史に残るだろう」と批判している。
特許リンケージを導入
特許リンケージとは、ジェネリック薬企業から製造承認の申請があると、政府の医薬品規制当局が、当該医薬品にかかる特許権者(新薬を開発した製薬企業)に通知を行い、特許権を侵害していないか確認することを義務付ける制度である(図3)。
米国は、特許権者に対する司法上・行政上の手続き(特許権者が訴訟した場合、係争中はジェネリック薬の製造承認を保留させるなど)を保障することを要求していた。米豪FTAや韓米FTAでも特許権者への通知制度が設けられた。
政府は守秘義務を理由にして、全くといっていいほど情報を提供してこなかった。ただちに「大筋合意」の詳細を国民に公表し、議論を尽くす必要がある。
以上
