【政策解説】見えてきたTPP
―公的保険に介入 薬が門口―
(全国保険医新聞2016年1月25日号より)
政府対策本部は、「協定の概要」(15年10月5日)、「協定の全章概要」(同11月5日)、「協定の暫定仮訳」(附属書を除く条文案、16年1月7日)を公表した。医療制度への影響と問題点を解説した。
特許期間の延長
米国はTPP交渉で、新薬の製造販売承認までの年数分、特許期間が「浸食」されていると主張し、その年数分だけ特許期間を延長して、特許権者に補償するよう求めていた。
「協定の全章概要」(第18章:知的財産)では、「不合理な短縮についての特許期間の調整」として、「販売承認の手続の結果として生じた有効な特許期間の不合理な短縮」について、「特許権者に補償する」ため、特許期間を延長するとしており、米国の要求が通った形だ。
新薬の研究開発プロセスには、主に、基礎研究、非臨床試験、治験、承認審査(厚労省による製造販売承認の審査)がある。特許出願は、基礎研究の段階で行われ、厚労省の承認を得た後に販売が認められる。特許法では「特許権の存続期間は特許出願の日から20年をもって終了する」(第67条)が、特許出願から市販承認までの期間を差し引けば、新薬市販後の特許期間は約10年程度となる。
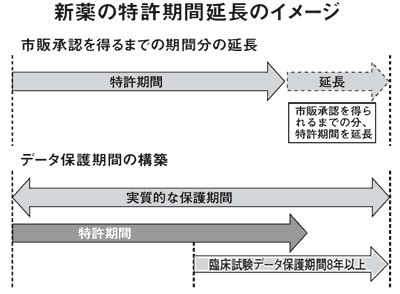 政府は「最長5年までの特許期間の延長制度」があるので、国内制度への影響はないと説明しているが、市販承認までの期間が「不合理な短縮」と認定された場合、特許期間の延長は5年を超え、10年以上となる危険がある。
政府は「最長5年までの特許期間の延長制度」があるので、国内制度への影響はないと説明しているが、市販承認までの期間が「不合理な短縮」と認定された場合、特許期間の延長は5年を超え、10年以上となる危険がある。
また、米国はバイオ医薬品のデータ保護期間について、政府の承認時から12年とするよう要求していた。
「協定の全章概要」では、「最初の販売承認の日から少なくとも8年間」、またはその代わりとして、「最初の販売承認の日から少なくとも5年間」と「他の措置をとる」ことのいずれかを選ぶことを規定している。
政府は、「新薬の再審査期間(承認時から8年)が、実質上のデータ保護期間として機能している」ので、国内制度への影響はないと説明しているが、保護期間の下限についてのみ規定しており、米国でのデータ保護期間と同じ12年にすることも可能である。
新薬の保護強化制度を導入し、製薬大企業の独占的販売を保障するねらいである。
薬価決定に影響力
「協定の全章概要」の「透明性及び腐敗行為の防止」(第26章)では、「医薬品及び医療機器のための透明性及び手続きの公正に関する附属書」を設けている。
「新たな医薬品又は医療機器に対する保険償還を目的とする収載のための手続き」について、「検討を一定の期間内に完了することを確保する」ことや、「独立した検討過程」を設けて、保険収載しないという「決定に直接影響を受ける申請者」が、不服審査を開始することができるとしている。
これまでも米国通商代表部は、新薬の特許が切れてもジェネリック薬が発売されるまでの間は高薬価を維持する「新薬創出加算」の継続・恒久化をはじめ、外国薬価が高くても日本の薬価が高くならないようにする「外国価格調整制度」の見直しを要求してきた。
今後、米国の製薬企業が、利害関係者として、TPP協定の「透明性」を盾にして、医薬品・医療機器の保険収載の可否や、公定価格の決定プロセスにいっそう影響力を及ぼすことが懸念される。
また、「日本国政府と米国合衆国政府との間の文書」では、「関連する将来の保健制度を含む」について、「協議する用意があることを確認」するとして、医療保険制度を協議対象とすることに合意している。米国政府や通商代表部の対日要求が、これまで以上に日本の公的医療保険制度に影響を及ぼす可能性がある。
米国の薬価は日本より高く、英国の3倍にのぼる。今後、わが国の薬価制度に米国流のルールが持ち込まれ、新薬価格が高騰するならば、さらなる患者負担増と医療保険財政の悪化を招くことになる。
以上
