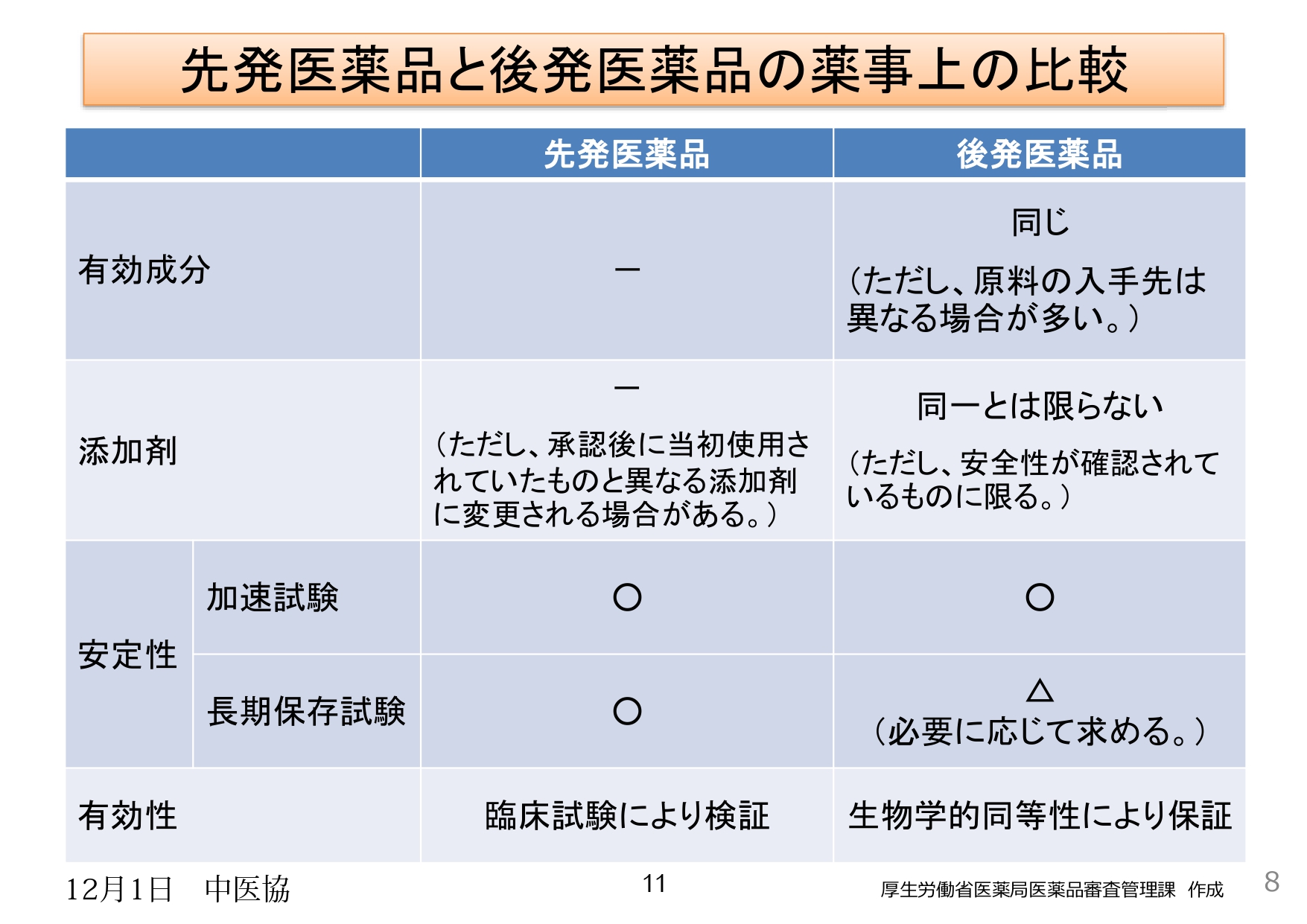
厚労省は、「後発品と先発品は同等」と主張し、その根拠として薬事承認の段階での薬の有効成分等で先発品と後発品の「同等性」を検査していると説明しています。しかし、薬の有効成分を収納する剤型(錠剤、顆粒、カプセル等)、基剤(軟膏、クリームなど)、添加剤などで違いがあり、患部に作用の仕方に違いが生じることを認めています。
何が違うのか? なぜ違うのか?
〇薬の有効成分で同等性が確保できているが、製剤化に実際に使用する段階で違いがあることは明らかとなっています
〇製剤化する段階で後発医薬品メーカーに製造特許がないこと等により、基材・剤型・添加剤の部分で異なる品質のものを使用せざるを得ないため、外用薬、内服薬とも、薬の有効成分が患部へ届かない、届きにくい状態が生じ、有効性に違いが出る場合があります。
〇溶連菌に感染した小児患者の場合、有効に作用する抗生剤を投与しないと重症化が懸念されるケースもあります。
〇PMDAが承認段階で同等性を確保・保障したとしても、市販後調査ができていないため、副作用情報も提供できません。また、後発医薬品メーカーが本来の製造方法とは異なる方法で製造していた、不純物が混入していたなど指導が入って信頼性が失われている段階で流通している製剤も同等ですとは言えません。信頼性が失われています。
〇少量多品種製造による薄利の業界体質が原因ではあるが、理由はともあれ後発品メーカーが欠陥品を作っていた事実があります。